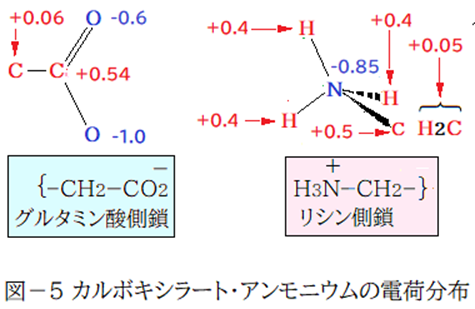
塩基性アミノ酸のリシン側鎖は体液中ではプロトン化され酸性基になる。酸性アミノ酸のグルタミン酸側鎖はカルボン酸の水素原子がプロトンとして脱離しカルボキシラートとなって塩基性基になる。両アミノ酸側鎖の総電荷量は酸性側:+1,塩基性側:-1である。しかし構成元素の電気陰性度の違いから両側鎖の内部も陰陽に分かれる。下図は100%私の主観で陰陽の電荷分布(図―5)を表した。結合する場合は、リシン側鎖では軌道(1s)が半分むき出しの三つの水素原子の何れかが主役となって結合する。グルタミン酸側鎖側は、カルボキシラートの陰電荷量が多い方の酸素原子が主役となって結合*する。その結合を緑の太線(図―3・4)で表した。その際、カルボキシラートの中心炭素原子、アンモニウムの中心窒素原子は結合を阻害するが、クーロン力は、「双方の電荷の積に比例し距離の二乗に反比例」だからカルボキシラートとアンモニウムの結合は成立する。
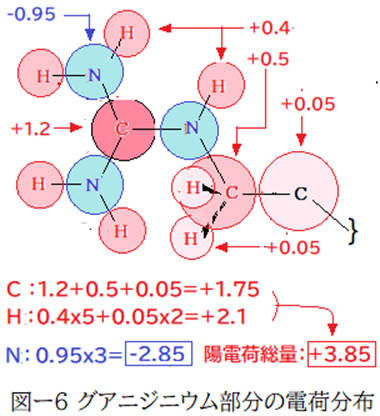
これも私の主観でアルギニン側鎖のグアニジニウムイオン部分の電荷分布を図-6で描いてみました。この画像では色の濃さで陰・陽の電荷量を表しています。グアニジニウムの中心炭素原子と三つの窒素原子は全てsp2混成状態である。中心の炭素原子はσ結合での陽電荷量とπ結合での陽電荷量の和は+1を超える。炭素原子と結合した一つの窒素原子は他の二つの窒素原子と陰電荷(量)が微妙に異なるはずだが、ここでは無視し、同等としている。
カルボキシラートとの結合の際、中心炭素原子の大きな陽電荷量はカルボキシラートの酸素原子との距離が遠いので大きなクーロン引力は生じない。窒素原子の大きな陰電荷量はカルボキシラートの酸素原子と反発し、結合を妨げる。従ってN-H一つ当たりの結合力は、リシン側鎖>アルギニン側鎖となる。
もっと単純に考えれば、リシンは主に5原子で、アルギニンは10原子で+1だからsp3とsp2の違いはあるが、1H当たりの結合力は、リシン側鎖>アルギニン側鎖となる。
* カルボン酸類の酸性度がアルコール類より高い原因として、カルボキシラートの共鳴安定化が常識となっているようだ。私はカルボニル基の誘起効果でカルボン酸類の酸性度にほぼ到達でき、共鳴効果は小さいと思っている。従って結合状態のカルボキシラートに関しては、酸素原子の陰電荷(量)を考慮すると共鳴は無い方が有利と思っている。カルボン酸・カルボキシラートの把握法に関しては別項を予定している。
