体液をpH7.4の緩衝液とすれば酸性アミノ酸側鎖は塩基(共役塩基)、塩基性アミノ酸側鎖は酸(共役酸)となる。塩基性アミノ酸として分類されるヒスチジンはその塩基性の弱さから安定した生化学で言う「塩橋」をつくれない。ヒスチジン側鎖はその特性から主にタンパク質が起こす化学反応の触媒作用の一部分を担当する。酵素タンパクでは、ヒスチジンは主役級なのだ。
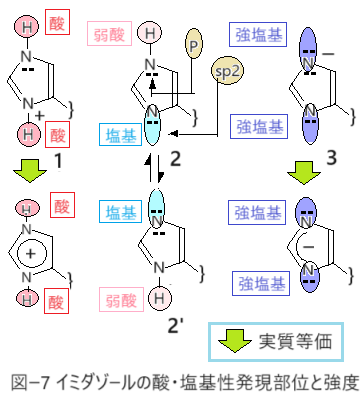
ヒスチジンイミダゾールは陰・中性・陽の三種が使える特徴(図ー7)がある。しかし3の陰イオンはイミダゾールのpka値から推定すると、体液(pH7.4緩衝液)にさらされるタンパク質の表面では存在できず仕事ができない。タンパク質がこしらえた穴の中で仕事をするのが役目だ。
他の酸・塩基性アミノ酸では使える化学構造は二種しか無い。カルボン酸ではCO2HとCO2―の二種、リシンのアミノ基もNH3+とNH2の二種だ。CO2HとNH2は主にタンパク質の穴の中で存在する。1に相当するプロトン化された陽イオン(CO2H2)+は使えず、リシンのアミノ基も3に相当するNH―は使えない。(CO2H2)+はは周辺に在る原子団を無差別的にプロトン化、NH―はプロトンを奪う。酸・塩基性が強すぎるので両イオンはタンパク質ではつくることもできないのだ。
ヒスチジンイミダゾールとは、5員環の6π電子系ヘテロ芳香環。つまり、5員環を構成する全ての原子がsp2混成状態なのだ。言うまでもないが、6個のπ電子は全てp軌道に入っている。Ⅰで述べたがp軌道の電気陰性度はs軌道,sp,sp2,sp3混成軌道に比べると電気陰性度が低い(電気陰性度の値が小さい)。と言うことは原子核からのクーロン引力が弱く電子が動きやすいのだ。図-8の2から2‘への反応に必要な活性化エネルギーは極めて小さい。くどいが、理由はアミジン構造内包5員環ヘテロ芳香環だから。また2のH-Nの酸性度は低いので図-8の反応はタンパク質の表面では不可能で、奥まった穴の中でしか起きない反応なのだ。
イミダゾール環の得意分野(仕事)を一言で言えば、電荷(電子対、プロトン)の他原子団への移動だ。図-8ではーXの電子対がーYに実質移動しているが、ヒスチジンイミダゾールが2から2‘に変化することで電子対の実質移動を助けている。この電子対の実質移動目的は、ーX-にはどうしてもできない仕事をーY-にやってもらうことだ。

