CF3CO2HとCH3CO2Hの酸性度は、前者が高い。CF3とCH3双方の電気陰性度を比較すれば、CF3 > CH3だ。従ってカルボキシラートのC原子の陽電荷量はCF3-C > CH3-Cとなる。これがアンモニウムとの結合にどのように関わってくるのか? を図―3に示した。

カルボキシラートのCの陽電荷(量)が多い(カルボン酸の酸性度が高い)場合は、このCと結合相手のアンモニウムのHとの反発力が強くなって結合を阻害する力が大きくなる。従ってカルボン酸の酸性度が高いカルボキシラートほどアンモニウム・グアニジニウムとの結合力は弱くなる。同様にアンモニウム・グアニジニウムでは塩基性が強いほどNの陰電荷(量)が多くなりカルボキシラートのOとの反発力が強くなり、H一つ当たりの結合力は弱くなる。
酸性原子団としてテトラゾールが使われることがあるが、カルボン酸との違いは異性体の存在である。私の解釈ではテトラゾール単独では陰電荷量1位と2位が離れ且つ陰が陽を挟んだ構造(1)がH体・陰イオン体共に安定と解釈。2,2’は陰電荷量1位と2位が隣に存在し陰・陰の反発力*が大きく不安定。環が陰イオンになっても1位・2位が逆転するだけで双方の位置関係は変わらない。前項(Ⅱ)で紹介した、私が思う三原子以上から成る原子団の安定化要因:「陰と陽は交互に在るのが安定」に反しているのが2,2’だ。しかしこの不都合状態は共鳴で解消(1=2‘’)できる。
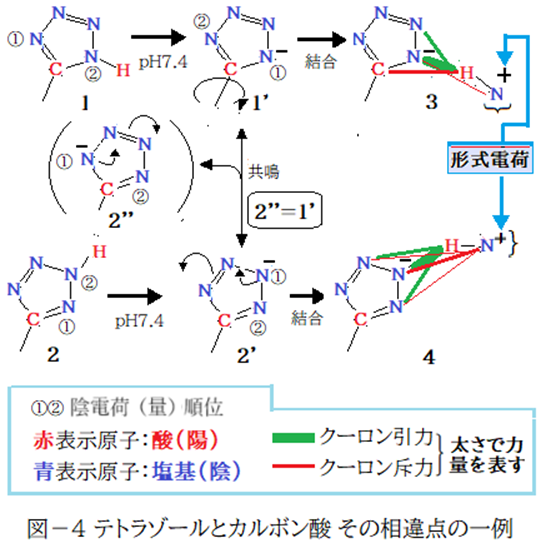
しかし、ここまではテトラゾール単独の場合だ。例えばアンモニウムと結合した状態では2’のテトラゾールのCとアンモニウムのHが遠く離れ且つテトラゾールの結合関与N原子が3原子となる4が有利となる可能性も考えられる。アンモニウムとの結合状態では4の陰電荷が転移しない方が有利となるのか? 私にはこれ以上の言及はできないので、興味のある方にお任せする。
*クーロン力は双方の電荷の積に比例し距離の二乗に反比例
