先ず双方の不対電子の活性度を比較すれば、NO2 > NOとなる。前述のようにNO2では不対電子がsp2混成軌道に、NOではp軌道に収容されるからだ。NO2のNはOと二重結合した上に電子対を供給し配位結合したNのsp2混成軌道なのだ。実質の電気陰性度の値は原子状態(4.13)を大きく上回るはずだ。混成軌道上の不対電子と混成軌道上の孤立電子対で超共役風安定化の可能性は? 私はあると思っているが弱酸・弱塩基の関係と平行するp軌道間ではないので安定化エネルギーは小さいと思っている。
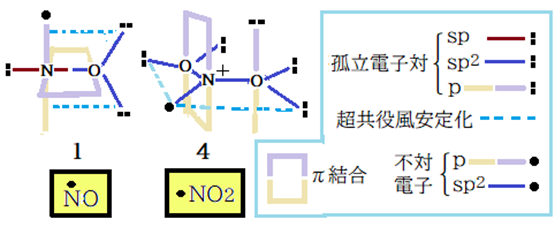
これから誘導体の比較をする。一言で言えばNO誘導体は複雑だがNO2誘導体は単純である。理由はNとOの結合がNOでは孤立電子対間の反発で脆弱。NO2ではNからの電子対供給で実現した配位結合で電子対間の反発は大幅に減少、その上共鳴による安定化が加わりN-O結合が強固になった。従ってNO2誘導体の中性分子での転移反応は起こらない。
双方一価原子(H,ハロゲン)誘導体では共通点が多い。既述のようにHの電気陰性度の値がNより小さいと前項(Ⅰ)で述べた架空酸素分子に電子状態が近づく。また「3原子以上から成る原子団は陰陽が交互に存在する構造が安定」に反する(H,N双方が陽に帯電)。
H-NO2は陽・陽の直結と原子の配置に無駄(N-HとO-Hの結合エネルギーの差/N-H<O-H)があり、転移してH-O-N=O(亜硝酸)に変化する。ハロゲンではNO,NO2双方電気陰性度の大きなF,Clが安定的に存在可能だ。理由はHの逆である。不安定なBr,I誘導体の理由はHと同じ。
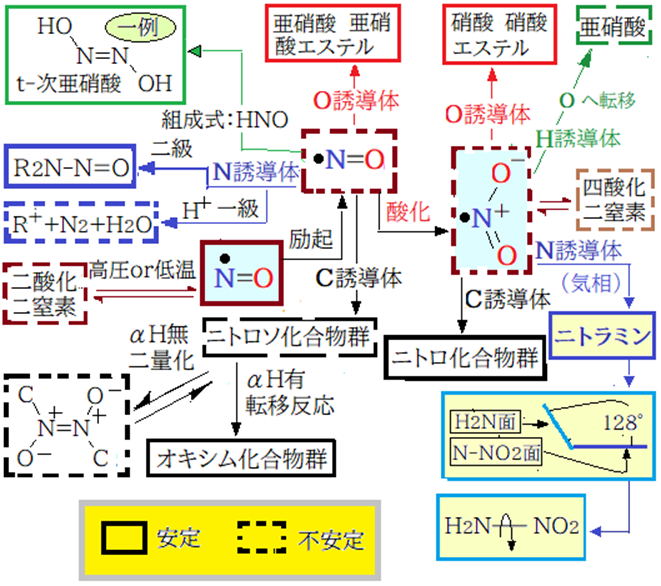
O誘導体は双方安定だ、理由を一言で言えば電気陰性度の値がO>Nだから。一酸化窒素誘導体ではO-N単結合の共有電子対がOに偏るので電子対間の反発が弱まり安定となる。二酸化窒素ではO-N単結合のOが陽に帯電しないから。
N誘導体は異なった結果となる。一酸化窒素誘導体ではαHが在る場合はR-N=N-OH → R-N+≡N → R++N2反応が起こりやすい。理由はN2が安定で生じやすい、N2が安定の理由は孤立電子対間の反発力がゼロ*になるから。
二酸化窒素のN誘導体は前述(二酸化窒素のN誘導体)のとおりである。
*同じ理由で次の二反応は起こりやすい。RO-N=O → N≡O+ ・・・亜硝酸は自身の酸性で分解 / R-CH=N-OH → R-C≡N(HとOHのトランス配置が最善)・・・ケトキシムでは反応条件を強めるとベックマン転位がおこる。
