くり返すが二酸化窒素はNとOの結合状態に問題点は無い。しかし不対電子の収め方にはエネルギー的な問題がある。その理由は不対電子の収め方に先んじて配位結合効果を優先したことにある。
水素:異性化し亜硝酸へと変化すると捉える。理由はO-HとN-Hの結合エネルギーの差と14,16は陽電荷を帯びる原子が直結することだ。

アルキル:水素誘導体より安定と捉える。理由はNとの結合電子対がNに偏ることで生じた陽電荷がメチル(16)では4原子に分散する。しかしH(14)の場合はそれができない。従って陽と陽の反発力は14>16となる。
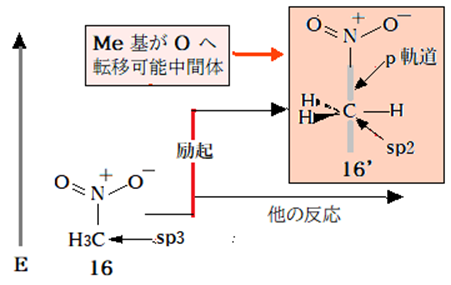
ニトロメタン(16)の亜硝酸メチル(17)への異性化が起こらない理由はもう一つある。異性化反応の活性化エネルギーがHに比べてMeでは格段に大きいこと予想されることだ。Hは原子軌道の半分を暴露しているがMeのCはHの鎧をまとって完璧に保護されている。脂肪族置換反応機構から考える。Cの軌道を暴露する一法はCがsp2混成状態(16’)に励起され、C-N結合のC側がp軌道に変らねばならないのだ。このレベルまで励起される前に16は他の反応を起こす可能性が高い。
ハロゲン:F,Clは安定だがBr,Iは不安定、電気陰性度の値が大きいほど安定は一酸化窒素と同じだ。しかし私の解釈では理由は違う。ハロゲンの電気陰性度の値が小さいとハロゲンの陽電荷(量)は大きくなる。その分Nの陽電荷(量)が減少することはない。ハロゲンから奪った陰電荷(量)以上に二つのOに持っていかれる。電子供与性の置換基はNの実質電気陰性度の値を下げるからだ。この結果NO2部分のイオン結合量が増し安定化する。反対にハロゲン-N結合部は陽・陽の反発力が増し不安定化する。
芳香環:一般的にはアルキル誘導体より安定のはず。理由はニトロ基との共鳴とそれによって生じた芳香環側の陽電荷を電気陰性度の値が最低のp軌道が担うこと、更にその電荷が芳香環全体に分散可能となるからである。しかしトリニトロトルエンやトリニトロフェノールのようにニトロ基が増えることでベンゼン環の陽電荷(量)が増えて不安定化が進む。
N誘導体:窒素酸化物の事典*によれば気相でのニトラミン(H2NNO2)のH2N面とNNO2面は52°ねじれている、更にN-N結合長:142.7pmとある。しかし、固相では両面は同一面に近くNH2基とNO2基の間に水素結合が観測される・・・との記述がある。 参考 H2N-NH2結合長:144.7pm , H2N-CN結合長:134.6pm/気相・マイクロ波分光法/化学便覧 800(2004), Me2N-NO 134.4pm/気相・電子線解析法/化学便覧807(2004)
気相でのニトラミンは平面ではない、とはH2NのNとNO2は共鳴してないことを意味する。共鳴が実現すれば両方のNが陽電荷を帯びその反発力が共鳴効果を上回るのだ。だとすればH2Nはsp3混成状態を採るだろう。孤立電子対は電気陰性度の値の大きな軌道に収容(塩基性度は低い程安定)することで安定化できるからだ。H2NはN-N結合軸で回転可能となる。
O誘導体:基本は気相のN誘導体と同じと捉える。OがNO2と共鳴すれば置換基側のOとNが陽に帯電し反発力が生じる。これを避ける一法は置換基側のOがsp3混成状態になることだ。硝酸のHO-N結合長は141pm(NO2のN-Oは120pm,121pm)、硝酸メチルではMeO-Nが140.2pm(NO2のN-Oは120.5pm,120.8pm)である。 参考:H2N-OHでは140.6pmである/化学便覧(2004年)
*窒素酸化物の事典:鈴木仁美(丸善)2008年
