二酸化窒素(4)と一酸化窒素(1)の関係は、Ⅰ-1で記した架空一酸化窒素のNの孤立電子対でOに配位結合したものが二酸化窒素である。これは架空酸素分子とオゾンの関係と同じだ。双方とも孤立電子対が共有電子対に変わることで電子対間の反発は激減した。その結果、二酸化窒素・オゾンは実在する物質となった。二酸化窒素は通常のラジカルと違ってsp2混成軌道に不対電子を収容する構造が最安定構造となっている。
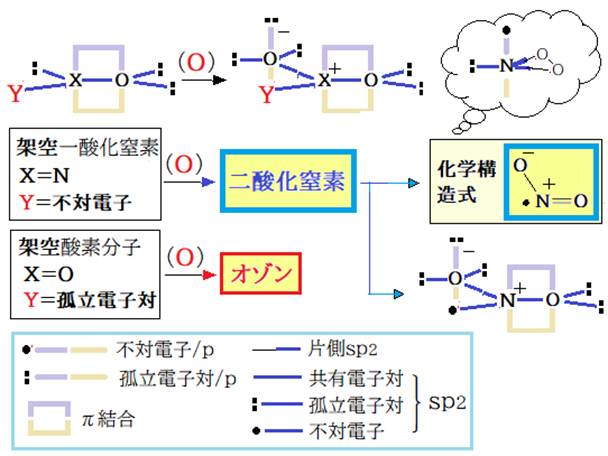
無理矢理p軌道に不対電子を収容する構造を探せば上図右上の「吹き出し」の中に描いた三員環となる。しかしこの構造は実際の結合角(<ONO=134.1°)*との間で整合性が無い。Nがsp混成を採ればp軌道に不対電子を収容できるが、それは下図4-C,D構造となる。赤色曲線で表した孤立電子対間最高反発は共鳴や本安定化作用の発現で小さくなるがゼロにはならない。仮に共鳴・本安定化作用で孤立電子対間の反発力が1/2になると仮定し、同反発力を数値化するとO原子はsp2混成状態が有利となる。既述の如くN,Oのみで構成する分子やO2と同じ境遇の原子団では孤立電子対間の反発力軽減が最重要となる。となればCとDは反発力が相対的に強いので除外でき、4-Aと4-Bの比較となる。

4-Aと4-Bの違いはNの混成状態の違い(A:sp2,B:sp)である。そしてNの混成軌道で双方がO原子の混成軌道(sp2)とで配位結合を成立させている。何れの配位結合エネルギーが大きいのか? となる。その判断基準は陰と陽の電荷(量)だ。陰陽の電荷(量)はNとOの電気陰性度の値の差に比例するはずだ。マリケンの電気陰性度(ポーリングの値に換算)では、N:sp2=4.13, sp=4.67 O:sp2=5.54である。電気陰性度の値の差は、Nがsp2で1.41、spで0.87である。この配位結合効果は不対電子がsp2混成軌道に在ることの不都合をエネルギー的に上回ったのだ。これでAが最安定構造との納得ができた。
一酸化窒素が酸化されてNとOの結合は安定化したが不対電子の方は逆に活性化した、これが二酸化窒素だ。
* 二酸化窒素の<ONO=134.1°(MW法) / 化学便覧(1984)基礎編Ⅱ 651頁・・・このデータでNの混成状態をsp2と判断。
**隣接原子の平行するp軌道上の孤立電子対によるp軌道の不対電子安定化作用(Ⅰ-3参照)
