既述のように下図の架空酸素分子(2)が存在しない理由は、孤立電子対間の反発力 > π結合実現力だ。換言すれば、孤立電子対間の反発力が働いて O-O 間の σ結合が伸び、p軌道間の重なりが実現不可能となっている。この状況は酸素分子が中性である限り酸素分子を拘束し続ける。しかし抜け道が一つあった。それは両方の O が π結合を諦めて sp混成の三重項酸素になることだ。そうすれば両方の不対電子・孤立電子対は互いに反発し、その結果 90°捻れた 1 の電子配置となって本安定化が実現する。
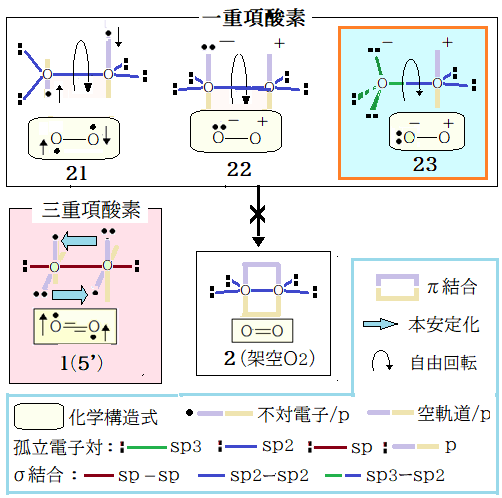
一重項酸素の安定系は空軌道を有することがわかっている。従って 21 は安定系ではない。更に O の混成状態がspで、本安定化が実現不可能な1(5’)から捻れた状態なら、孤立電子対間角 90°が多くなるので sp混成状態の O は片方・両方とも除外できる。
以上を考慮すれば 一電子移動した分子内塩タイプの 22 or 23 となる。右側 O は空軌道を一つ設けなければならない。孤立電子対を全て混成軌道に収め、空の軌道を p軌道に割り振れるのは sp2混成状態だけだ。左側 O は、三つの孤立電子対を安定的に収容するには sp3しかない。従って23が一重項酸素の安定構造となる。
