第二周期元素で構成する中性原子団に限れば、本安定化エネルギーは三つの要素から成り、その力の序列は
ⅰ 安定化を行う側(塩基):孤立電子対 > 共有電子対
ⅱ 双方の原子軌道:並列する2p軌道間 > それ以外
ⅲ 酸・塩基の強度による三分割( 強中弱 ):強・強 >、(中・中)> 弱・弱
隣接する二原子間での酸と塩基の強・中・弱を定義する
酸:不対電子が電気陰性度の値が大きい原子側:強 逆:弱 双方同原子:中
塩基:孤立電子対が電気陰性度の値が小さい原子側:強 逆:弱 双方同原子:中
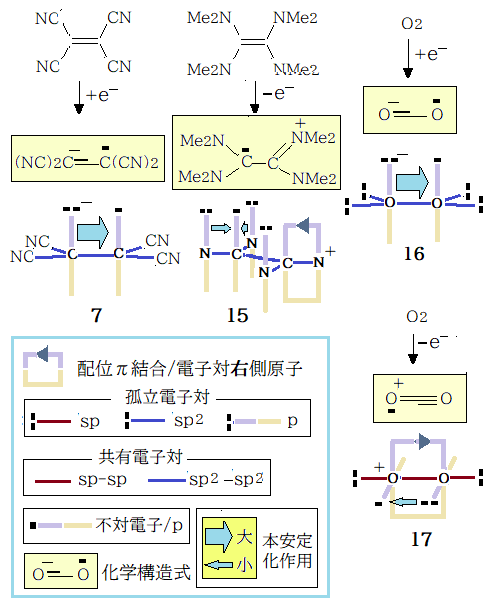
酸素分子の酸・塩基性度は、二つの中酸・中塩基による安定化である。これによる安定化エネルギーは本相互作用二つと σ結合との合算で二重結合には届かない程度と私は推定する。・・・・本安定化作用の力量は、ニトロキシルラジカル( 6 )で大きく、架空一酸化窒素 (3 )では小さく酸素分子 ( 1 )はその中間に在る。
ここまで中性原子団で説明したが、イオン原子団の説明をする。双方が同じ原子でも化合物 7,16 では陰電荷を帯びている方が強塩基となって中酸・中塩基より大きな安定化が実現する。陽イオン(15,17 )の場合は配位π結合・本安定化作用の両方が実現する。17 では O2 全体に陽電荷が分散*し、15 での陽電荷は右半分のテトラメチルアミジンの全体に分散し左側C不対電子に及ぼす電子吸引力は小さく弱酸・弱塩基の関係は変らない。その代わり15 , 17 共に新たに配位π結合が成立し、これは絶大である。16 でも陰電荷を帯びた左のOの実質電気陰性度の値は右のOより小さくなりσ結合の電子対は右のOに偏るが陽電荷の 17 ほどは中和されない。15 , 17 のように本安定化作用の力が小さく構造決定因子になり得ない場合は化学構造式では表示しない。なお三原子以上から成る原子団(7,15)の安定化要因は次項( 一酸化窒素・二酸化窒素とその誘導体/Ⅱ )に記す。
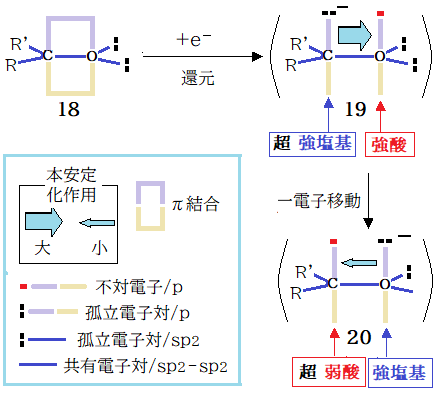
本安定化の力量の増大を図る一法は、カルバニオン直結の酸素ラジカルが考えられる。しかし、カルボニルの一電子還元で 19 が生成したとしても即 20 へ移行するのでは? 20 は強塩基と( 超 ) 弱酸の相互作用となり大きな安定化は望めない。しかし、置換基 ( R, R’ )の工夫によっては 19 が存在? ・・・
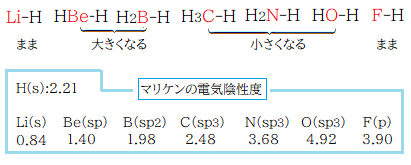
マリケンの電気陰性度**では軌道毎の値があり化学構造式に対応している。その値は s性が高いほど大きくなる(s > sp > sp2 > sp3 > p )。この値は各原子の単独原子状態での値である。故に二つ以上の他原子と結合状態にある原子ではその原子の潜在能力であることを考慮しなければならない。赤表示元素の水素化物の実際値は下図のようになる。
*陽電荷は可能な限り多原子間に分散するが、陰電荷は電子親和力が最大の原子に留まる。これは静電相互作用で結合状態にある原子団の私の捉え方で、別項で説明の予定。
** mullikenの電気陰性度:化学便覧 基礎編Ⅱ 1133(1966)には軌道毎の値の記載がありポーリングの電気陰性度に換算した値もある。この話での値は全てポーリングの値に換算した数値である。
