・・・隣接原子の並列するp軌道の孤立電子対によるp軌道の不対電子安定化作用・・・
本安定化作用を緩やかに表現すれば、「隣接原子の電子対による空軌道・不対電子安定化作用」となる。突然空軌道が出現したが、後述の安定化が実現する理由での原子軌道の「酸・塩基」の見地から、不対電子と空軌道が共に「酸」であるとすることによる。
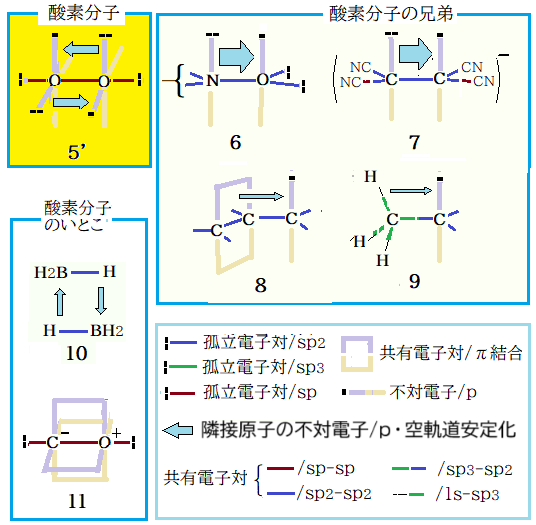
この緩めた表現に当てはまる「酸素分子の兄弟・いとこ」は、6~11 がある。6 は超安定なニトロキシドラジカル、7 はテトラシアノエチレンラジカルアニオン、8 はアリルとアリールメチルラジカル、9 は超共役による安定化だ。10 は三中心二電子結合のジボラン、11 は配位 π結合が実現した一酸化炭素である。5‘ ~ 7 はp軌道上の不対電子が隣接原子のp軌道の孤立電子対で、8 , 9 は共有電子対で、10 は異なる原子団間で空のp軌道を互いの共有電子対で、11 は空軌道が隣接原子の孤立電子対で安定化(配位 π結合)される。
要は、これら7 種原子団で安定化が実現する理由である。私は「酸・塩基相互作用」として説明する。ルイスの酸*・塩基の定義では、酸:電子対受容体、塩基:電子対供与体である。このルイスの酸・塩基の概念を原子軌道に適用する。酸は、空と不対電子の軌道空間に在る。塩基とは、各種軌道上の孤立・共有電子対である。安定化の力量は酸・塩基の強度 ( 次頁:④参照 ) で決まる。強酸と強塩基なら大きな安定化を、弱酸と弱塩基では安定化力は小さい。
上図の青塗り矢印の幅の広さで安定化のおおまかな力量を私の主観で表している。共有電子対による安定化( 8, 9, 10 )では塩基性度が孤立電子対に比べて低くなるので安定化力は小さくなる。そして 8 > 9 となる。理由は次項にあるが、C-Cのπ結合電子対とC-Hσ結合電子対の存在する原子軌道の電気陰性度( 後述:8 )である。
酸素分子を中心にすれば、一酸化炭素は「いとこ」相当だ。配位結合を中心に分類すれば、5‘ ~ 10 は不完全配位結合原子団群である。配位結合に関しては次項 ( Ⅱ:私が見た一酸化窒素・二酸化窒素とその誘導体 )で詳述の予定。
* ルイス及び私以外の人達は不対電子がルイスの酸との位置づけを認めてない、これが現状だ。しかし不対電子がルイスの酸と仮定すれば多くの現象が統一的に説明可能となる。例えば、メチルラジカルが何故平面構造なのか?に対しては、不対電子の酸性度をできる限り低く(P軌道に収容)、三つの共有電子対の塩基性度をできる限り低く(混成軌道に収容)を実現するのが炭素原子のsp2混成状態なのだ。 「 酸性度・塩基性度は低いほど安定」
電子対の反発(sp2=120° , sp3=109.5°)でも説明可能だが、不対電子の酸性度・電子対の塩基性度、双方を最低にする手段としての炭素原子のsp2混成 でも説明可能だ。メチルラジカル平面構造の説明で、①電子対の反発 ②不対電子と電子対の酸・塩基性度最低化 、双方が同じ答え(C→sp2)となる。これは「ラジカルはルイス酸」であることを証明する一件ではないのか。
酸素分子を「三電子結合」で説明する方法は在るが、酸・塩基相互作用の概念では、本作用による安定化力のランク付けが原子軌道の電気陰性度から可能となる。例えば下図で安定化力が最大の一酸化炭素ラジカルアニオンの安定化エネルギーは、C-O間のπ結合エネルギー + 一酸化炭素の電子親和力 と言える。オクテット側を満たし且つ中性化合物である一酸化炭素の電子親和力がプラスの値であることを説明できる。

