酸素分子と同じ境遇(拡張原子価殻電子対反発則支配)に在る原子団とは
① 第二周期元素の二原子から成る原子団
② 両方の原子に孤立電子対が在る
③ 双方の2p軌道上の電子が結合に関与
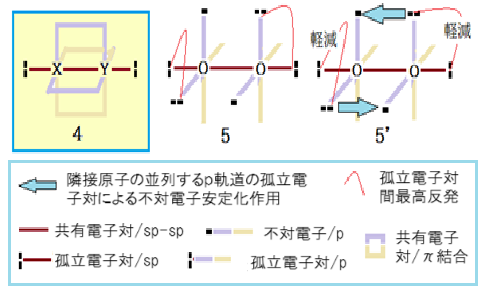
1~3に当てはまる酸素分子以外の原子団は、CN-, CO, N2, NO, NO+, O2+, O2-である。これら原子団は拡張原子価殻電子対反発則が支配する故に、孤立電子対間の反発を最小化すれば最安定化が実現する。具体化すれば N2 分子型( 4 )構造となる。これに習った酸素分子が 5だ。しかし三重結合は実現しない。π 結合は二電子で成立するからだ。更に両原子に孤立電子対間角90°の孤立電子対がある。従って 5 は原子価殻電子対反発則での評価は最悪だ。この状態(5)で安定化できる新概念が必要となった。
その概念を二本の青塗り矢印(5’)で表した。これが「隣接原子の並列するp軌道の孤立電子対によるp軌道の不対電子安定化作用」を表す。この作用で不対電子の安定化が実現する。そして安定化エネルギーに比例した原子内での孤立電子対間の反発軽減が実現する。つまり、孤立電子対が不対電子を安定化すると、不対電子の安定化に比例して孤立電子対性を失う、と言える。これで不対電子の安定化と孤立電子対間の反発軽減の両方が同時に実現する。