酸素・一酸化窒素分子の基底状態はラジカルである。この事実は、この二分子がオクテット則の支配圏には在らず他の法則の支配圏内に在ることを意味する。酸素分子を支配しているのは何か? それは電子対間のクーロン反発力である。この反発力は既に「原子価殻電子対反発則」として法則化されている。本則では電子対間の反発力を、孤立電子対間 > 孤立電子対と共有電子対間 > 共有電子対間とする。私は本法則を隣接原子間にも適用(拡張原子価殻電子対反発則)した。
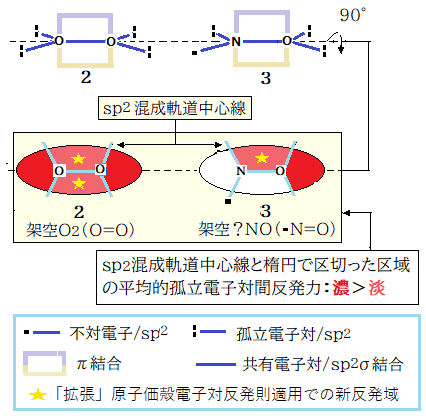
酸素分子が上図の2(sp2混成状態の二重結合)を構成すれば
1)四つの孤立電子対が同一面に固定される
2)二重結合(双方のp軌道が重なる)が可能な距離内に二原子が留まる
3)①②の同時実現は孤立電子対間の強い反発で不可能
それ故に酸素分子は 2(二重結合)を構成することができない、と解釈。
一酸化窒素(3)では孤立電子対の一つが不対電子に変る。その結果孤立電子対間の反発域は半減する。それ故に N, O 双方のsp2混成状態での二重結合が2より安定である。先走って話すと、一酸化窒素は 3 より更に安定な構造があり、それはラジカル状態に特有の構造である。その特有構造はマリケンの電気陰性度(後述)と原子価殻電子対反発則から導き出せる。一酸化窒素とその誘導体は別項(Ⅱ:後日追加)を設ける。
