一酸化炭素同様にカルボニルのπ結合のラジカル解列を伴い、カルボニルC原子に一電子を収容した場合(図-4)を考える。この場合もラジカルアニオン(2--)の「隣接原子の原子軌道間酸・塩基相互作用」による大きな安定化(青塗り矢印/図-4)が実現する。
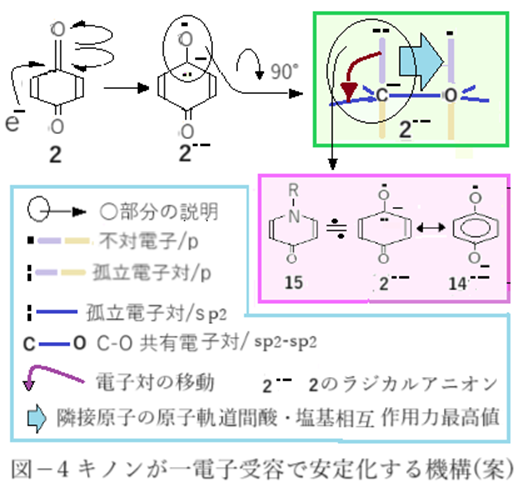
また、ラジカルアニオン(2--)のカルボニルC原子のp軌道上の孤立電子対が環と共役した場合はハイドロキノンラジカルアニオン(14--)と互いに共鳴極限構造の関係にある。また2のラジカルアニオン(2--)はピリドン(15)と同様の電子配置でありラジカルアニオン状態がキノンより安定なことが納得できる。電子親和力の値が、一酸化炭素<キノンであることも納得だ。キノンの一電子受容では「一石二鳥」が実現するのだ。
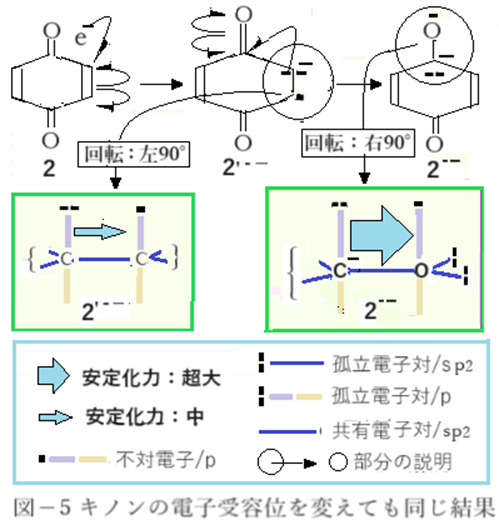
仮に一電子受容の位置が変わった場合(図-5)を考える。これまでは全てカルボニルC原子受容で考えた。2のごとく対象型キノンではカルボニル以外のC原子は全て等価なのでどこに一電子を受容しても同である。カルボニルC原子以外で受容(2’--)すれば隣接原子の原子軌道間酸・塩基相互作用による安定化力はカルボニルC原子の場合に比べてはるかに弱い。それ故にカルボニルC原子に電子対が移動したラジカルアニオン(2--)に変化する、と解釈する。