概要
1 電子対間の反発力で化学構造が決まる物質群があり、酸素分子はその群に属す
2 酸素分子では隣接原子の電子対でラジカルが安定化されている
3 ラジカルの安定化を酸(不対電子)・塩基( 電子対 )相互作用として説明可能
4 この捉え方の究極状態が配位結合で、酸素分子は「 不完全配位π結合×2 」
5 不完全配位π結合でも条件が揃えばニトロキシドラジカル群の如く大きな安定化が得られる
決め事
- 不対電子がp軌道に収まる場合は元素記号の上か下に不対電子を描く
- 不対電子が混成軌道に収まる場合・収まる軌道が特定できない場合は元素記号の横に描く
- 本安定化作用は短線( 化学結合を表す線の1/2の長さ )で表す
- この短線は安定化を及ぼす原子側から不対電子と同じ側( 上か下 )に引く
- 大きな安定化は太線、酸素分子のように同じ原子間の場合はσ結合と同じ太さ
- オキシゲニル( O=O+ )・( Me2N )2C-C=N+Me2のごとく本安定化作用の力が小さい場合は描かない
- 共有電子対の電気陰性度の値は両原子の結合にあずかる軌道の平均値とする
- 孤立電子対の電気陰性度の値は同電子対が収まる軌道の 1/2 とする
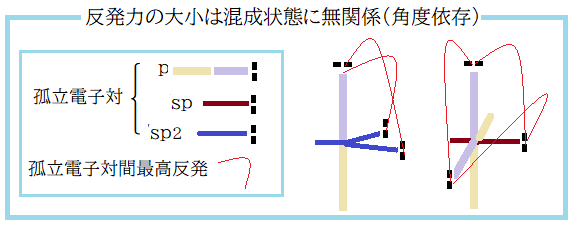
- 孤立電子対を p軌道に担わせた場合の同一原子内の孤立電子対間の反発力は下図のように決める