一酸化炭素(1)の電子親和力は135kJ/mol(1.4eV)である。プラスの値であることから化学反応的に表現すれば発熱反応である。図-2を見ながら読んでください。1より1のラジカルアニオン(1・-)の方が低エネルギー状態なのだ。1のラジカルアニオン(1・-)はカルボアニオンである。Ⅰ-4で記したが、カルボアニオン直結Oラジカルは、隣接原子の原子軌道間酸・塩基相互作用の発現には最高の環境なのだ。1・-の「隣接原子の原子軌道間酸・塩基相互作用」による安定化エネルギーは一モル当たり135kJ+COのπ結合エネルギー一つ分相当*となる。故に一酸化炭素ラジカルアニオン(1--)の場合はCからOへの一電子移動はエネルギー的に不利となるので起こらないと捉える。電子がどうして1のマイナス符号の付いたCを攻撃するのか? の疑問には以下のように説明できる。一酸化炭素(1)のマイナス符号はOのプラスと同じ形式電荷だから実質的にはカルボアニオンではない。仮に、電子がOを攻撃してO陰イオンCラジカル(C・=O-)となれば弱塩基・「超」弱酸の関係となって酸・塩基相互作用による安定化エネルギーは極小(Ⅰ-4参照)となる。それ故に電子はO原子を攻撃するメリットが無い。Cを攻撃することでカルボアニオン直結Oラジカルが生じて低エネルギー状態が実現するのだ。仮にOで一電子受容しても一電子移動で安定な1・―に転移するだろう。
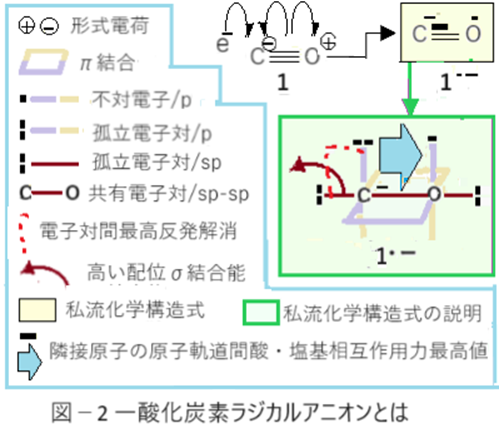
図-2の緑線で囲った部分は、私流化学構造式(黄塗り部分)の説明とCOラジカルアニオン(1・―)の特徴を表している。青塗り矢印の幅の大小で安定化量を表し、図-2の幅を最大とし、これはⅠ-6で記したニトロキシドラジカルを上回る。更にCOラジカルアニオン(1・-)のC原子のsp混成軌道上の孤立電子対には高い配位結合能が在るはずだ。この状態で配位結合すれば配位σ結合が実現する。
- 実はそれほど単純ではない。一酸化炭素ラジカルアニオン(1--)に変化すればC原子側が陰イオンに変わるので実際の電気陰性度の値は小さくなる。そうなればσ結合と残ったπ結合の電子の偏りは中性の一酸化炭素より大きくなる。その結果C原子とO原子のイオン結合性が増し二重結合エネルギーは 1<1-- となる。従って1の電子親和力は1モル当たり「135kJ+COのπ結合エネルギー一つ分」より小さくなる。また次のことも言える。双方同じ原子の場合は電子親和力の値は、二重結合<三重結合となる。完璧な例とは言えないが、R2C=NR3 < RCN , R2C=O < CO となるだろう。
