1 炭化水素の H を F に交換(共有電子対の弱塩基化)すると超共役による安定化力が弱まる
2 ラジカルは「酸性度が低い程安定」から、第二周期元素・化合物のラジカル活性度は, C < N < O < F となる
3 ② から O と F のラジカルは炭化水素の水素引き抜き剤として有効
4 マリケンの電気陰性度の値は、s > sp > sp2 > sp3 > p となる故に不対電子( 酸 )をp軌道に収容する場合が安定構造がとなる( 酸・塩基性度は低いほど安定 )
5 ④ から炭化水素のラジカルの安定度は、Et・> H2C=CH・ > C6H5・> HC≡C・ の如く予測可能、Et・と H2C=CH・は p軌道に不対電子を移せるが、C6H5 では難 しく、HC≡C・では不可能
6 ④ から孤立電子対( 塩基性度が低い程安泰 )をp軌道に担わせてはならない{ 例外:本安定化作用( 三重項酸素 )、共鳴( 二酸化窒素 )、芳香化( ピロール環, シクロペンタジエニルアニオン )}
7 ④ から R3C,R2N, RO 各陰イオンの混成状態は sp3 と予測可能、R2B 陰イオンはsp2、RBe 陰イオンはsp、Li は原始状態( s )と予測可能
8 脂肪族置換反応での脱離基はp軌道から脱離:反応中心原子が sp3 → sp2 へと励起され脱離基が反応中心原子のp軌道に在る時反応が進む・・・更に親核試薬が反応中間体を系中で最安定化する場合ワルデン反転した生成物となる
9 ⑧ 関連、sp3 → sp2 への励起が起これば立体構造の反転(下図 )が可能だ。C 誘導体は孤立電子対が無いので原子価殻電子対反発則から励起エネルギーは N. O に比べて大きいはず・・・これでアミン類の光学分割が難しいことを納得。しかし N に配位結合させれば孤立電子対が消滅、C と同格になって光学分割可能との予測が・・・ O ではオキソニウムになってもこの段階でアミンと同格( 孤立電子対一つ )なのでオキソニウムの光学分割は難しいことも予測可能
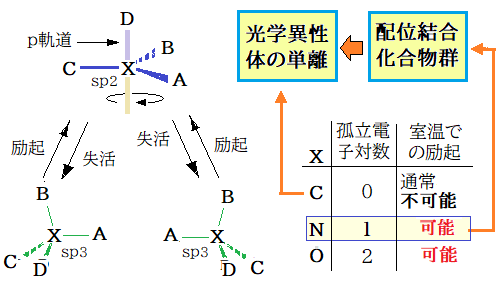
10 ⑦ から R1R2R3C- はアミン類程度ラセミ化し易いと推定可能、故に立体保持を図った置換反応は注意深く速やかに低温で行うか、カルバニオンを安定化する工夫が必要
11 芳香族親電子置換反応はπ電子( 芳香環の電子対で電気陰性度最低 )が親電子試薬に配位結合する行程が発端
12 カルバニオン直結 O ラジカルが存在可能ならばニトロキシドラジカル群より更に安定なラジカルとなるが ・・・
